innis lab


Protéger contre les envahisseurs bactériens
Peptides antimicrobiens
Les peptides antimicrobiens (AMP) sont de petits polypeptides naturels présents dans toutes les formes de vie, où ils agissent en tant que puissantes molécules de défense, soit en supprimant les concurrents microbiens chez les bactéries, soit en jouant un rôle clé dans le système immunitaire inné des eucaryotes.
Alors que la menace de résistance aux antibiotiques et que les infections émergentes continuent de se répandre, les AMP attirent l’attention en tant qu’alternatives prometteuses aux antibiotiques conventionnels.
Nos recherches se concentrent sur les AMP qui ciblent les composants bactériens intracellulaires, tels que le ribosome, dans le but de découvrir leurs mécanismes d'action et de développer de nouvelles thérapies à base de peptides.
Nos publications phares
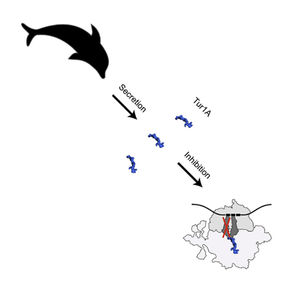
Peptides antimicrobiens riches en proline (PrAMP)
Les peptides antimicrobiens riches en proline (PrAMP) produits par la réponse immunitaire innée des insectes et des mammifères présentent une puissante activité antimicrobienne contre les bactéries Gram-négatives et représentent donc une voie prometteuse pour le développement d'antibiotiques.
En utilisant la cristallographie aux rayons X, nous avons obtenu des structures à haute résolution de divers PrAMP de type I en complexe avec le ribosome 70S de Thermus thermophilus. En combinaison avec des études biochimiques, nos structures ont montré que ces molécules de défense de l'hôte inhibent la transition de la phase d'initiation à la phase d'élongation de la traduction en se liant au tunnel de sortie et au centre de peptidyltransférase du ribosome (Seefeldt et al., 2015 , Seefeldt et al., 2016 , Mardirossian et al., 2018).
En utilisant la biologie structurale, la microfluidique à base de gouttelettes et la biochimie, nous continuons d’explorer les mécanismes par lesquels les composés antimicrobiens naturels ciblent et inhibent la machinerie de traduction bactérienne.
Inhibition des ribosomes par les PrAMP de type I. Le PrAMP Onc112 inhibe la synthèse des protéines bactériennes en bloquant et en déstabilisant le complexe d'initiation de la traduction. D'autres PrAMP de type I, comme Bac7, la métalnikowine ou la pyrrhocoricine, fonctionnent selon un mécanisme similaire.
Surmonter la barrière de perméabilité des bactéries
Les peptides antimicrobiens apparaissent comme des alternatives prometteuses aux antibiotiques traditionnels dans la lutte contre les bactéries résistantes. Malgré un intérêt croissant, la conception rationnelle de nouveaux peptides dotés d'une puissante activité in vivo demeure un défi majeur. Cela est dû en grande partie à notre compréhension limitée de la manière dont les peptides pénètrent et s'accumulent dans les cellules bactériennes, en particulier chez les espèces à Gram négatif, dont l'enveloppe à double membrane constitue une barrière redoutable.
Notre groupe s'attache à élucider les facteurs moléculaires et structurels qui permettent aux peptides d'atteindre et d'inhiber des cibles intracellulaires chez les bactéries Gram-négatives. Nous nous intéressons particulièrement aux peptides qui interfèrent avec le ribosome bactérien, une cible privilégiée de l'action antimicrobienne.
Afin d'accélérer les découvertes dans ce domaine, nous développons une plateforme innovante de criblage à haut débit basée sur la microfluidique en gouttelettes. Cette approche nous permet de lier le phénotype (activité antibactérienne) au génotype (ADN codant pour les peptides), permettant ainsi l'identification rapide de nouveaux peptides ciblant les ribosomes et présentant un potentiel thérapeutique.